Esta es la tercera publicación de una serie dedicada a describir los aerosoles del vapeo, sus propiedades, su régimen óptimo de funcionamiento y comparaciones con el humo del tabaco y otros aerosoles. Comprender cómo se forman los aerosoles del vapeo, cómo funcionan y cómo pueden ser evaluados proporciona el conocimiento necesario para entender su uso placentero, su perfil tóxico y su seguridad relativa en comparación con el humo del tabaco, otros aerosoles y contaminantes.
Este conocimiento (que intento presentar de forma accesible) refuerza nuestra confianza en el papel del vapeo en la reducción de daños y nos permite contrarrestar la desinformación ignorante y malintencionada.
Describí en la Parte 2 el régimen óptimo del vapeo en términos de física térmica como un equilibrio de intercambio de energía que puede evaluarse en laboratorio mediante curvas funcionales que relacionan la potencia suministrada (W) con la masa de e-líquido vaporizado (MEV).
En esta publicación explico lo que ocurre cuando un dispositivo de vapeo se utiliza o se somete a pruebas en laboratorio dentro del régimen de sobrecalentamiento, es decir, a niveles de potencia superiores al régimen óptimo, y por tanto a temperaturas de la resistencia por encima de los puntos de ebullición del e-líquido.
Describo los procesos térmicos que tienen lugar bajo este régimen, cómo modifican el proceso de ebullición, provocando un aumento exponencial de subproductos tóxicos y culminando en un punto crítico conocido como “calada seca” (dry puff). Son procesos complejos e inestables cuyos detalles completos aún no se comprenden del todo.
¿Qué puede salir mal en el régimen de sobrecalentamiento?
El régimen de sobrecalentamiento, cuando se vapea con una potencia suministrada por encima del régimen óptimo, se caracteriza por procesos térmicos mucho más energéticos e inestables que alteran significativamente el equilibrio cíclico del intercambio de calor propio del proceso de ebullición. Esto aumenta el calor residual y modifica la composición química del aerosol. Los usuarios perciben estos cambios, ya que vapear un dispositivo en estas condiciones deja de ser sensorialmente agradable.
Ebullición nucleada
Cuando la temperatura de la resistencia supera la temperatura de ebullición del e-líquido, la ebullición continúa, pero se vuelve más energética e inestable que la ebullición normal descrita en publicaciones anteriores, siguiendo dos regímenes: ebullición nucleada y ebullición en película (film boiling).
Este tipo de regímenes también ocurre en otros sistemas térmicos donde un elemento calefactor —normalmente una resistencia— calienta un líquido: calderas eléctricas, hervidores y reactores nucleares.
La ebullición en piscina (pool boiling) describe un sistema térmico en el cual el elemento calefactor metálico (una resistencia) está completamente sumergido en un líquido dentro de un recipiente cerrado y aislado. Es la analogía más simple para ilustrar lo que podría suceder en un dispositivo de vapeo.
La transición de ebullición normal a nucleada y luego a ebullición en película se describe teóricamente mediante la curva de Nukiyama (Figura 1), que representa el flujo de calor suministrado q = Calor / (área x tiempo) = Potencia / área como función Tc – Tb, la diferencia entre la temperatura de la resistencia y la temperatura de ebullición.
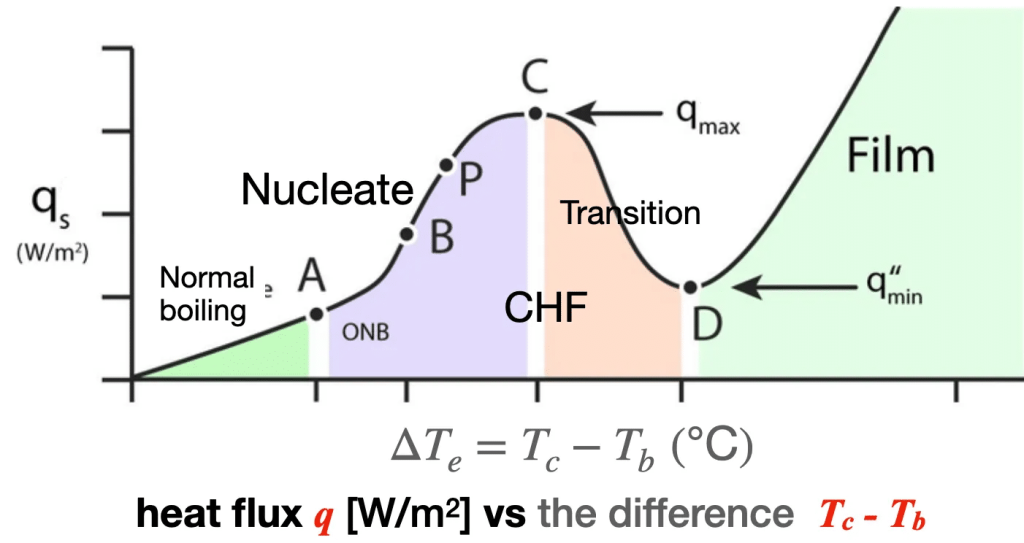
A la izquierda del punto A tenemos la ebullición normal, descrita en la Parte 1 y la Parte 2. Inicialmente se forman pequeñas burbujas de aire que se desplazan siguiendo patrones circulares simples de convección, absorben vapor y se agrupan en la superficie del líquido, donde estallan y liberan vapor.
La ebullición nucleada (del punto A al punto B) se inicia al suministrar una secuencia de pequeñas cantidades fijas de calor adicional (más potencia en la resistencia) en una serie de pasos. Tras suministrar calor en varios incrementos, las burbujas se vuelven más numerosas, grandes y móviles, fluyendo por todo el volumen del líquido siguiendo patrones de convección muy complejos. Esto se muestra esquemáticamente en la Figura 2 y mediante fotografías en la Figura 3.
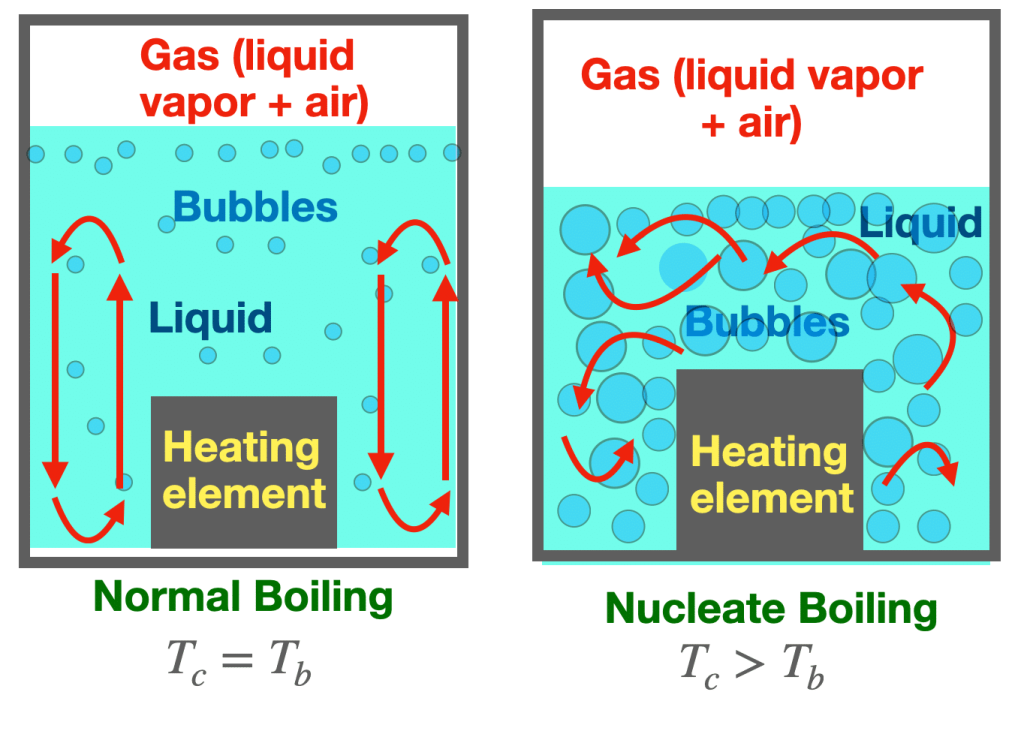

Las burbujas absorben calor y se llenan de más vapor del líquido mezclado con aire, aumentando su presión interna para equilibrar la presión del líquido, volviéndose lo suficientemente estables como para chocar, fusionarse y agruparse (nucleación) gradualmente en burbujas más grandes alrededor del elemento calefactor.
Sin embargo, contrariamente a lo que cabría esperar, el calor adicional suministrado a la resistencia durante la ebullición nucleada no genera un aumento proporcional de vapor respecto a la ebullición normal (como sí ocurre en el régimen óptimo). A continuación explico por qué.
El calor latente de vaporización es la cantidad de calor que debe absorberse a temperatura de ebullición constante para vaporizar una masa líquida determinada. Este calor disminuye lentamente a medida que aumentan la temperatura y la presión, y se anula únicamente en una condición extrema conocida como “punto crítico” (normalmente a presiones extremadamente altas).
En sistemas térmicos cercanos a la presión atmosférica, el calor latente de vaporización se mantiene aproximadamente constante, por lo que el calor adicional suministrado no se traduce en un aumento significativo de la masa de vapor generada. Sin embargo, la vaporización continúa y el nivel del líquido disminuye.
A nivel microscópico, la cantidad de vapor producido depende directamente de la proporción de moléculas líquidas que logran escapar de la superficie hacia la fase gaseosa, una vez que su energía cinética (energía de movimiento) supera la energía de enlace de las fuerzas intermoleculares que las mantienen unidas en estado líquido. Dado que la temperatura es el promedio de la energía cinética molecular, este escape molecular se produce cuando el calor extra eleva suficientemente la temperatura, permitiendo la vaporización.
No obstante, cuando hay un exceso de moléculas en la fase gaseosa, estas pierden energía al colisionar entre sí y regresan al líquido (se condensan). Por lo tanto, el excedente de calor en la ebullición nucleada no produce una cantidad de vapor significativamente mayor en proporción al calor adicional suministrado a la resistencia.
En su lugar, el aumento de temperatura incrementa la energía cinética molecular, que se ve contrarrestada por un mayor número de colisiones (y más condensación). El nivel del líquido desciende igual que en el régimen óptimo, pero lo hace más rápidamente en cada incremento.
A medida que se suministra más potencia (calor), la temperatura de la resistencia se eleva y el calor residual se acumula. Dependiendo de las propiedades químicas del líquido, a cada nuevo incremento de calor pueden activarse reacciones químicas en la fase gaseosa que antes estaban inactivas a temperaturas por debajo del punto de ebullición, haciéndose más energéticas y generando subproductos en mayores concentraciones. Lo mismo ocurre en un dispositivo de vapeo.
Flujo crítico de calor hacia la ebullición en película
A medida que se siguen suministrando incrementos de potencia al elemento calefactor (del punto B al punto P), su temperatura continúa aumentando, las burbujas siguen creciendo y fusionándose, hasta llegar a cubrir una parte significativa del elemento calefactor y de la superficie líquido-gas, absorbiendo más calor.
Conforme avanza el proceso (de P a C), al suministrar aún más potencia y aumentar rápidamente la temperatura del calefactor (Tc), se alcanza un valor máximo del flujo de calor, conocido como flujo crítico de calor (Critical Heat Flux, CHF), punto en el que la curva de Nukiyama (Figura 1) alcanza su pico máximo y el flujo de calor empieza a disminuir (de C a D), aunque la diferencia de temperatura Tc−TbT_c – T_bTc−Tb siga aumentando.
Esto ocurre porque las burbujas ahora cubren una porción lo suficientemente grande del elemento calefactor como para formar una película que lo aísla parcialmente del líquido, reteniendo dentro de dicha película el calor suficiente como para contrarrestar el flujo de calor suministrado. Es la transición hacia la ebullición en película (film boiling).
El punto D, donde la curva de Nukiyama presenta un mínimo —conocido como punto de Leidenfrost—, se caracteriza por la formación completa de una película de burbujas que cubre por completo el elemento calefactor, aislándolo del líquido y reteniendo todo el calor que se le suministra, lo que provoca un aumento dramático de su temperatura.
Sin embargo, es importante subrayar que resulta muy difícil verificar experimentalmente esta parte teórica de la curva de Nukiyama más allá del CHF y hacia el punto de Leidenfrost, ya que la expansión de la película para cubrir completamente la resistencia es un proceso extremadamente inestable, que ocurre a temperaturas muy elevadas. En esta etapa, el líquido se agota hasta niveles en los que el elemento calefactor deja de estar completamente sumergido, desestabilizando y colapsando la película, mientras el elemento libera toda su energía retenida por radiación, alcanzando temperaturas que pueden superar los 1000 °C.
En este punto crítico, los alambres pueden fundirse y la mayoría de las estructuras físicas fallan y se rompen —algo que incluso puede ocurrir ya en el CHF.
¿Y qué pasa con el vapeo?
Existen similitudes entre la ebullición en piscina (pool boiling) y los dispositivos de vapeo: ambos implican un elemento calefactor metálico y líquidos que hierven. Sin embargo, hay dos diferencias fundamentales:
- Diferencia en la evacuación del vapor:
En la ebullición en piscina, el suministro de calor paso a paso puede ser absorbido mediante la evacuación del vapor por convección forzada, por ejemplo, para calentar agua destinada al baño —pero nadie lo inhala. En cambio, en el vapeo, el proceso ocurre en ciclos de caladas: en cada paso, el calor suministrado se absorbe casi simultáneamente para vaporizar el e-líquido y también se extrae por convección forzada a través de la inhalación. - Exposición al aire:
En el vapeo, el elemento calefactor (la resistencia) está expuesto al aire a través del conducto de inhalación, incluso si está completamente sumergido en el e-líquido. Cuando el nivel del líquido disminuye, aumenta la exposición de la resistencia al aire, lo que complica las variables térmicas del proceso de ebullición.
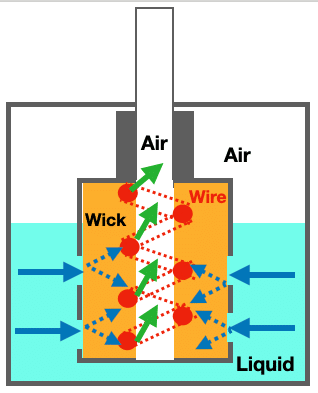
Sin embargo, la diferencia más importante está en la estructura del elemento calefactor. En el vapeo, no se trata de una simple resistencia metálica, sino de una estructura compleja en la que hilos metálicos se enrollan alrededor de una biomasa orgánica (el algodón), ambos en contacto con el aire del conducto de inhalación (ver Figura 4). Como consecuencia de esta complejidad, el intercambio de calor entre los hilos, el e-líquido y el aire muestra una dependencia muy complicada de las propiedades físicas del metal y de la geometría de la resistencia y la mecha.
Dos propiedades físicas son esenciales para entender el intercambio térmico en los vapes:
- Capilaridad: la capacidad del líquido para ascender por las fibras de la mecha.
- Mojabilidad: la capacidad del líquido para extenderse y cubrir superficies sólidas. Esta propiedad varía mucho entre superficies metálicas (como los hilos) y superficies porosas (como las fibras del algodón).
La acción combinada de estas dos propiedades varía ampliamente entre diferentes diseños de dispositivos de vapeo, lo que dificulta la comprensión completa de los efectos térmicos en condiciones de sobrecalentamiento.
Vapear bajo un régimen de sobrecalentamiento, con temperaturas por encima del punto de ebullición (188–288 °C), también puede representarse mediante la parte de Ebullición Nucleada de una curva de Nukiyama hasta el punto de Flujo Crítico de Calor (CHF), es decir, del punto A al punto C en la Figura 1.
Sin embargo, dado que el funcionamiento de los dispositivos de vapeo implica ciclos de caladas con suministro y absorción de calor (Potencia = calor/tiempo), las curvas funcionales presentadas en la Publicación 2, que relacionan la masa de e-líquido vaporizado (MEV) con la potencia, ofrecen una representación más adecuada de las condiciones de sobrecalentamiento.
Como en la ebullición en piscina, la vaporización del líquido permanece prácticamente estancada (Figura 5), mientras el calor residual se acumula en cada paso de calor suministrado. A temperaturas superiores a los 300 °C, las burbujas se vuelven más grandes y enérgicas, agrupándose alrededor de la resistencia (ver Figura 3).
Los niveles de líquido disminuyen rápidamente tras cada calada, ya que el calor residual adicional eleva la temperatura del líquido en masa, disminuye su viscosidad y favorece tanto la capilaridad como la mojabilidad del líquido.
A medida que se suministra más potencia en caladas sucesivas, las burbujas se fusionan para formar películas aislantes que cubren parcialmente los hilos de la resistencia y retienen el calor, aumentando aún más la temperatura del hilo calefactor hasta alcanzar el flujo crítico de calor (CHF), aproximadamente entre 400 y 450 °C.
Esta es la transición de la ebullición nucleada hacia la ebullición en película, cuyo punto final es la llamada “calada seca” (dry puff), una evolución diferente a la de la ebullición en piscina, como explicaré más adelante.
Crecimiento exponencial de subproductos tóxicos
Las reacciones de degradación térmica (pirólisis de baja energía) que ocurren al vaporizar un líquido también pueden tener lugar en la fase gaseosa de un escenario de ebullición en piscina, pero en los dispositivos de vapeo esto tiene importantes implicaciones para la seguridad.
La velocidad de estas reacciones en la fase gaseosa depende exponencialmente de la temperatura y de una energía de activación E0, que varía según cada reacción (ley de Arrhenius). Esta dependencia puede ilustrarse esquemáticamente en la Figura 6 a continuación.
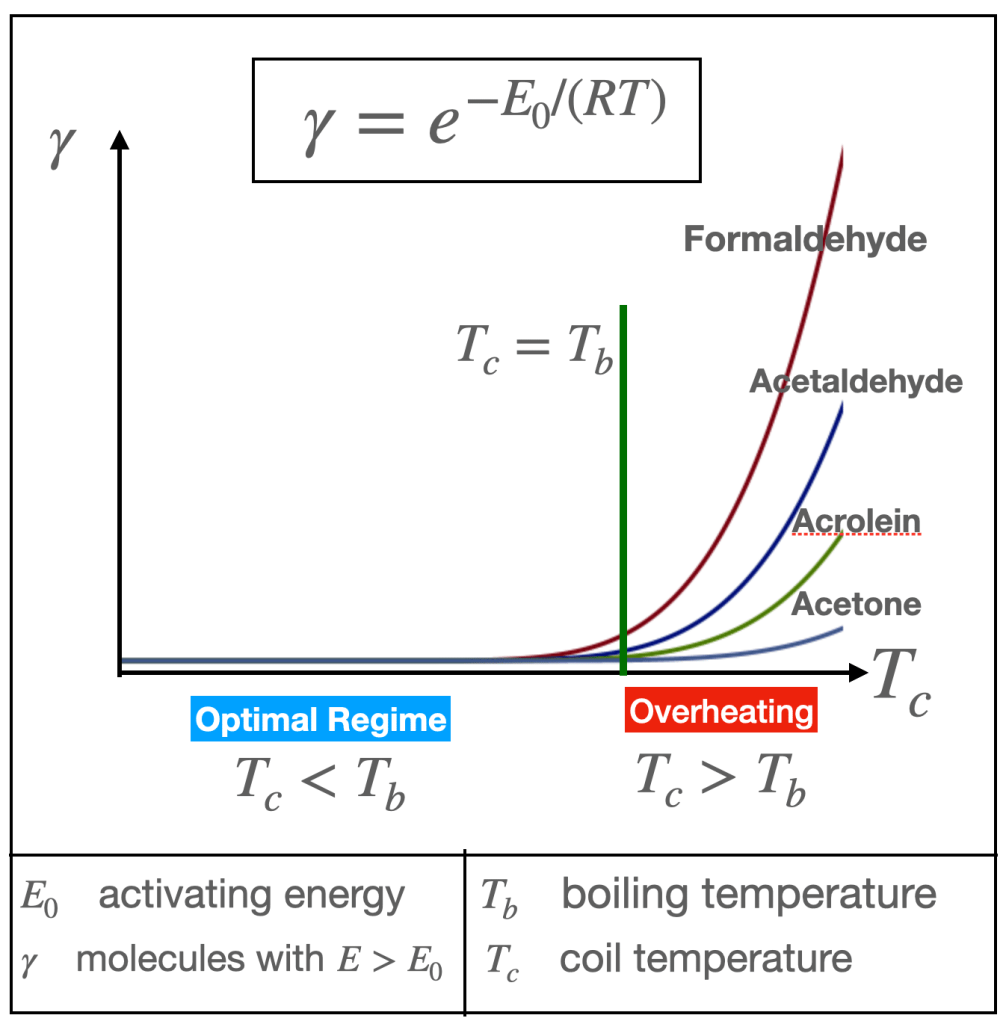
La velocidad de reacción (gamma) es la proporción de moléculas con energía E superior a la energía de activación E0, la cual varía en función de cada reacción (y, por tanto, de cada subproducto generado).
Bajo el régimen óptimo, la vaporización ocurre a una temperatura de ebullición aproximadamente constante Tb, que coincide, de forma local (alrededor de la mecha), con la temperatura de la resistencia Tc. A esta temperatura (o por debajo de ella), la velocidad de reacción gamma es muy baja (corresponde al lado izquierdo de la curva exponencial en la Figura 6, con un crecimiento prácticamente nulo), lo que implica que las reacciones térmicas son débiles y generan cantidades mínimas de subproductos, aunque generalmente se observan niveles algo mayores de formaldehído.
Operar un dispositivo dentro del rango de potencia definido por el régimen óptimo permite vaporizar el líquido alrededor de la mecha a la temperatura de ebullición Tb, manteniendo las velocidades de reacción en valores muy bajos.
Sin embargo, cuando la temperatura de la resistencia Tc supera la temperatura de ebullición del e-líquido, las velocidades de reacción crecen exponencialmente (como se muestra esquemáticamente en la Figura 6).
Esta transición —de niveles insignificantes o mínimos a un aumento exponencial en la producción de aldehídos— ocurre justo al alcanzar la potencia suministrada W que marca el paso del régimen óptimo al régimen de sobrecalentamiento. Esta es la potencia máxima que aún permite que las reacciones tengan lugar a una temperatura cercana entre el líquido y la resistencia.
Estos efectos pueden observarse en laboratorio.
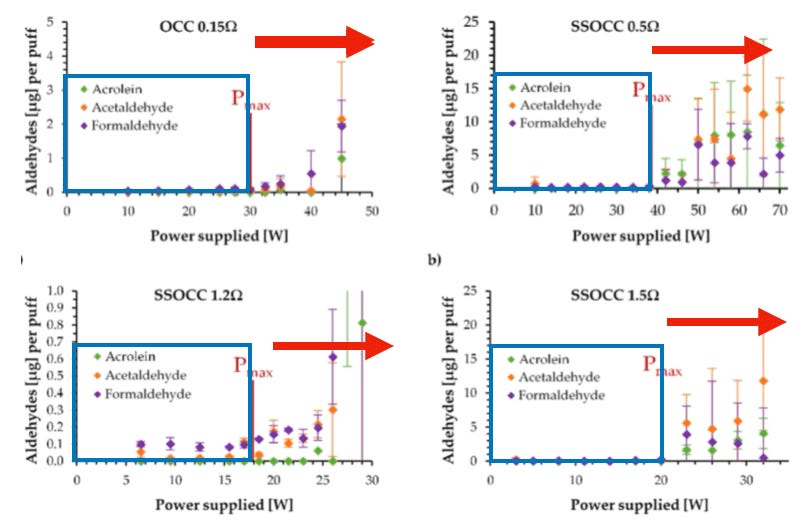
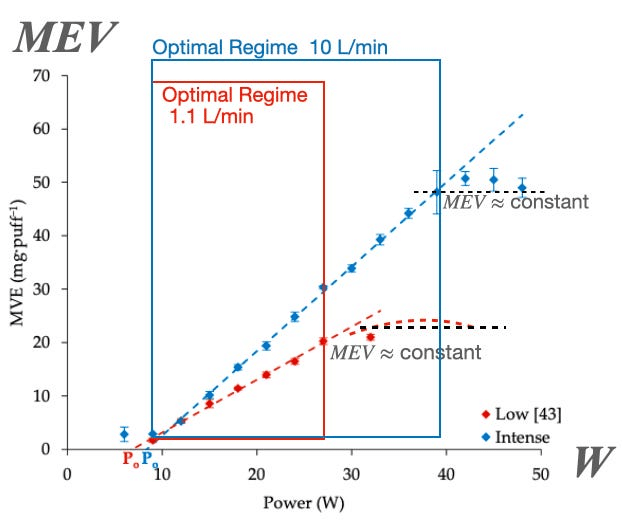
Fuente: Soulet et al. https://doi.org/10.1038/s41598-023-43733-3
Los rectángulos azules en la Figura 7 indican los rangos de potencia correspondientes al régimen óptimo, mientras que los puntos de colores marcan el rendimiento de producción de los tres principales aldehídos: formaldehído, acetaldehído y acroleína. Obsérvese cómo los niveles de aldehídos se mantienen muy bajos dentro del régimen óptimo, pero su producción se dispara exponencialmente al entrar en el régimen de sobrecalentamiento (tal como lo predice la ley de Arrhenius representada en la Figura 6).
A medida que la temperatura de la resistencia aumenta (300–350 °C) dentro del régimen de ebullición nucleada, las reacciones de degradación térmica se vuelven más energéticas (pirólisis más intensa), lo que conlleva una producción drásticamente mayor de subproductos, tanto en cantidad como en variedad.
Los vapeadores no perciben directamente la intensidad de la ebullición, pero sí perciben un aerosol más caliente, ya que el calor residual acumulado eleva la temperatura de la mezcla de aire y vapor dentro del atomizador, de sus paredes y de la boquilla. Además, perciben el aumento rápido de los subproductos como un deterioro del sabor, incluso sin que se haya agotado el e-líquido (es decir, sin llegar a una “calada seca”).
Sin embargo, lo que los usuarios perciben de forma más clara y marcada es el deterioro del sabor debido a los productos de las reacciones pirolíticas de la celulosa de la mecha, en particular los furanos, caracterizados por un sabor y olor amargo, similar al de la almendra amarga. Tal como muestran las siguientes fotografías (no se trata de un experimento controlado, sino de una evaluación cualitativa), el inicio y la progresión de la pirólisis en la mecha con el aumento de la temperatura pueden apreciarse visualmente con facilidad:

Tostar pan: una analogía útil para entender la pirólisis
Tostar pan es una analogía útil para comprender la pirólisis (y la combustión como su punto final). Un nivel bajo de potencia aplicado a la tostadora produce una rebanada marrón clara y sabrosa (pirólisis de baja energía). Si se aumenta la potencia, el pan se oscurece, aunque (hasta cierto punto) sigue siendo comestible —todavía dentro de la pirólisis leve.
Prácticamente todos los consumidores aceptan el pan tostado en ese nivel o inferior. Pero a partir de cierto umbral, la rebanada se vuelve marrón oscuro y deja de ser agradable. Si se sigue aumentando la potencia, el sabor se degrada aún más, el pan se vuelve repelente e incomible (pirólisis energética). Si se continúa, se incendia y se quema (combustión).
Aplicado al vapeo: vapear en condiciones de sobrecalentamiento es tan desagradable como comer una tostada quemada, y la “calada seca” (dry puff) es el equivalente al pan completamente carbonizado.
De la ebullición nucleada a la ebullición en película y la “calada seca”
La transición de la ebullición nucleada a la ebullición en película en dispositivos de vapeo no es igual que en la ebullición en piscina, ya que el líquido está en contacto con un elemento calefactor complejo: un hilo metálico enrollado alrededor de una mecha de algodón (ver Figura 4). Las películas formadas a lo largo del hilo conducen calor, mientras que el aire del conducto de inhalación forma burbujas adicionales de aire y vapor dentro de la mecha, ya parcialmente pirolizada (ver Figura 8), cuya presión puede superar la del líquido restante.
Dado que el calor no se retiene completamente en las películas que cubren los hilos, no hay un punto Leidenfrost (“C” en la Figura 1). En su lugar, al alcanzar el flujo crítico de calor (CHF), las películas y burbujas colapsan rápidamente, liberando energía al aire, mientras el líquido se agota por completo y el hilo transfiere calor por radiación casi instantánea, con temperaturas que pueden alcanzar hasta 1000 °C. Este fenómeno es lo que se conoce como “calada seca” (dry puff).
La “calada seca”: punto final crítico del régimen de sobrecalentamiento
La calada seca no es un evento aislado donde “todo iba bien” hasta que, de repente, ocurrió un desastre al agotarse el e-líquido. No obstante, en los primeros dispositivos de vapeo —que funcionaban a baja potencia (menos de 5 W) y no tenían control de voltaje o potencia—, el proceso de sobrecalentamiento hasta la calada seca ocurría de forma abrupta (percibida como instantánea) y era fácil que el usuario no notara la rápida disminución del líquido.
Los dispositivos de segunda y tercera generación, con rangos de potencia más amplios y controles ajustables (potencia, voltaje, flujo de aire), permitieron a los usuarios evitar fácilmente las caladas secas.
Además, podían sentir un aerosol más caliente o detectar la degradación del sabor al comienzo del régimen de sobrecalentamiento, antes de llegar a la repulsión total que provoca el agotamiento completo del líquido.
En estos dispositivos de mayor potencia, el régimen de sobrecalentamiento es más gradual, ya que pueden operar de manera óptima en intervalos más amplios.
Las máquinas de vapeo de laboratorio pueden seguir funcionando durante todo el régimen de sobrecalentamiento, incluso hasta una calada seca, pero los usuarios humanos interrumpen el vapeo cuando perciben un aerosol caliente o un deterioro del sabor/olor —ya sea abruptamente o de forma progresiva— como resultado de los procesos térmicos y los cambios químicos del aerosol explicados en este texto. Todo esto es crucial tenerlo en cuenta al probar dispositivos en laboratorio.
¿Qué sigue? Preludio a la Parte 4
Ahora ya sabemos cómo se define y se puede probar experimentalmente el régimen óptimo para un vapeo placentero. También comprendemos qué ocurre en condiciones de sobrecalentamiento, que también pueden ser evaluadas en laboratorio.
En la próxima publicación, resumiré cómo se analiza el aerosol de los dispositivos de vapeo en la literatura científica. Veremos cómo los estudios que reportan niveles excesivos de subproductos tóxicos (superando los umbrales de seguridad) pueden rastrearse siempre hasta errores metodológicos, incluyendo el hecho de probar los dispositivos en condiciones de sobrecalentamiento.
Este artículo fue traducido y adaptado al español por el equipo de Vaping Today. Publicación original: A full guide to vape aerosols, formation, properties and comparisons: Post 3. Si encuentra algún error, inconsistencia o tiene información que pueda complementar el texto, comuníquese utilizando el formulario de contacto o por correo electrónico a redaccion@thevapingtoday.com.
La entrada Una guía completa sobre los vaporizadores – Parte 3 se publicó primero en VAPING TODAY.
